1型糖尿病是自身胰岛β细胞无法分泌足够的胰岛素引起的糖尿病,虽然病例总数不到糖尿病整体的10%2,但1型糖尿病的患者只能通过注射胰岛素控制血糖,因此终生无法摆脱频繁注射的痛苦。2023年11月,日本东北大学的科学家发现,利用近红外光照射激活小鼠的迷走神经可以促进胰岛β细胞的增殖,调节胰岛素的分泌从而治疗小鼠的1型糖尿病。该研究被发表在《自然·生物医药工程》(Nature Biomedical Engineering)期刊上。
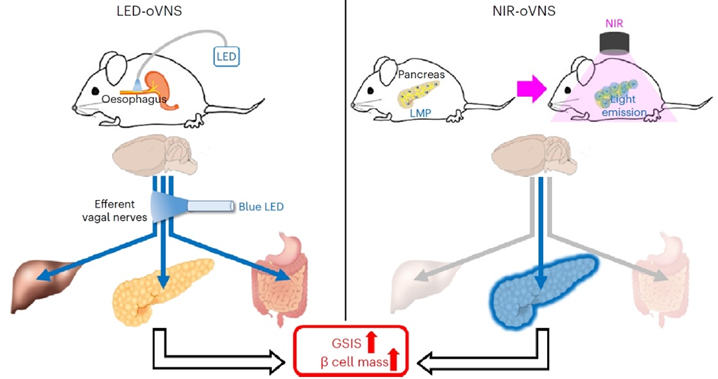
如同字面意思那样,迷走神经在人体中的走位“如同迷雾一般”,它主要调控循环、呼吸和消化系统,而胰腺作为分泌消化液和激素的腺体同样受到迷走神经的调控。在实验中,研究人员首先利用基因编辑的方法将光遗传蛋白ChAT-ChR2引入到小鼠的迷走神经中,使得迷走神经可以被特定波长的光信号操控。接着,研究人员通过手术将一根光纤植入到了小鼠体内,使得外界的光源可以直接作用于迷走神经上。
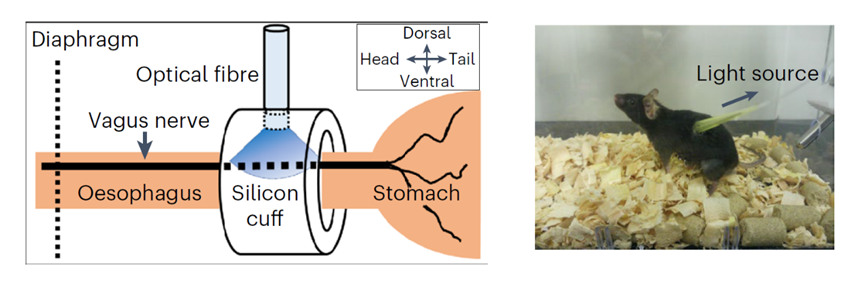
植入手术完成的一周后,小鼠的日常活动已经基本无碍,研究人员在接下来的两周内用照射频率为5Hz的蓝光LED持续刺激小鼠的迷走神经。结果显示,LED蓝光刺激显著促进了小鼠胰岛β细胞的增殖。不过,实验组小鼠在接受葡萄糖耐受测试的过程中虽然分泌出了更多的胰岛素,但实际血糖指标却与对照组没有显著差异。

在上述实验的基础上,研究人员又探索了一种新的刺激迷走神经的手段,以避免植入光纤对小鼠自由活动的持久影响。在同样用转基因手段引入光遗传蛋白ChAT-ChR2后,研究人员将镧化物微粒(lanthanide microparticles, LMP)注射到了小鼠的胰腺中。这些微粒在近红外(near-infrared, NIR)光的照射下会发出蓝光,从而刺激小鼠的胰腺周围的迷走神经。为了避免如热效应等干扰因素对实验结果的影响,研究人员将会发出红光的镧化物微粒注射到了对照组小鼠的胰腺中,这些微粒发出的红光无法有效刺激小鼠的迷走神经。
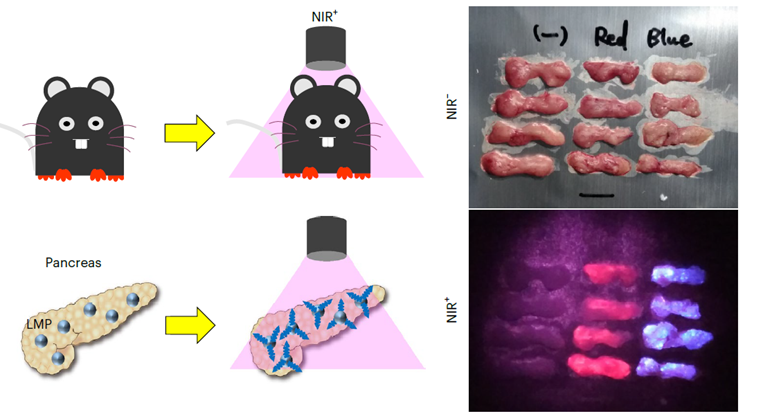
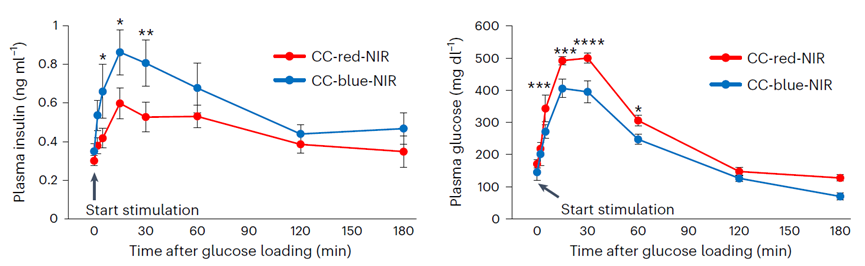
结果显示,通过镧化物微粒发光的形式同样可以刺激小鼠胰岛β细胞的增殖,同时还使得小鼠在葡萄糖耐受测试中分泌出更多的胰岛素,血糖下降得也更显著。在接下来的实验中,研究人员在链脲佐菌素 (Streptozotocin, STZ)诱导的1型糖尿病小鼠身上进一步验证了这种疗法的有效性。
综上所述,本次研究发现,利用光遗传学的手段刺激小鼠的迷走神经可以促进胰岛β细胞的增殖,使其分泌出更多的胰岛素并达到治疗1型糖尿病的效果。事实上,刺激迷走神经的手段已经在临床上被初步应用于脑卒中患者的运动能力恢复上3,而本次研究为人类1型糖尿病的治疗带来的新的思路,或许在未来能帮助患者免受或少受频繁注射的痛苦。