人体对外界刺激的感知,依赖于神经元之间的信号传递。髓鞘是神经元的构成单位之一,负责提高信息传递的速度及保证信息传递的正确性。如果髓鞘受到破坏,则会引发神经系统功能障碍。
比如多发性硬化症就是最常见的一种中枢神经脱髓鞘疾病。因其致残率高,且高发于青壮年,常被称为“不死癌症”。既往研究显示,肥胖是诱发多发性硬化症的关键风险因素,但具体作用机制尚不完全清楚。
近期,美国排名第一的医院梅奥诊所的研究人员,对肥胖引发脱髓鞘疾病的具体机制提出了新的理论依据。即通过抑制CD38合成来提高NAD+水平,可提高因肥胖而导致的髓鞘再生能力下降。目前该研究已在《神经科学杂志》(Journal of Neuroscience)发表。
CD38是哺乳动物体内主要的NAD+降解酶,可以分解NAD+,降低NAD+水平。“使用CD38抑制剂或通过其他方式提高NAD+水平,可能是治疗脱髓鞘疾病的新方案。”研究人员说。
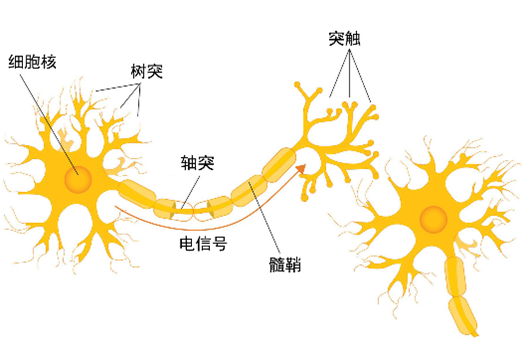
事实上,肥胖与脱髓鞘疾病,及脱髓鞘疾病与CD38的关系已被多项研究证明过。比如2014年加州大学伯克利分校的研究人员就发现,肥胖会使罹患脱髓鞘疾病的风险增加;《细胞神经科学前沿》的一项研究表明,脱髓鞘疾病的实验动物中CD38水平显著增高。
但是三者之间的相互关联一直未得到证实,本次研究则是通过NAD+,将肥胖、髓鞘和CD38联系在一起。
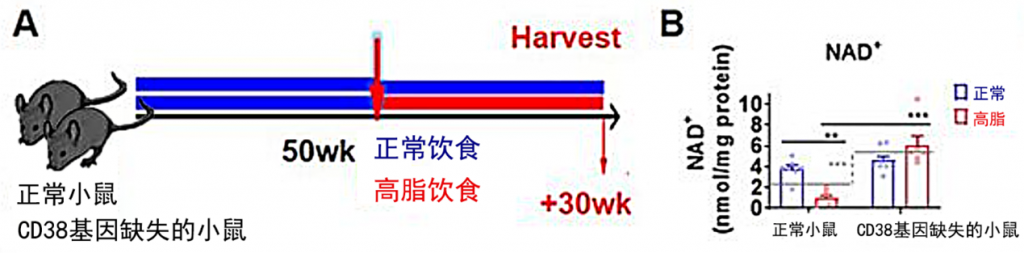
在实验中,研究人员将50周的正常小鼠和CD38基因缺失的小鼠打乱后随机分为2组,并给2组小鼠分别喂食正常饮食和高脂饮食30周。结果发现,正常小鼠高脂饮食后,其体内NAD+的水平显着降低,但CD38基因缺失的小鼠没有因为高脂饮食而出现NAD+水平下降。这说明,高脂饮食可通过提高CD38的含量来降低NAD+的水平。
同时,研究人员发现,正常小鼠高脂饮食后,其中枢神经系统内的少突胶质细胞数量减少。这与《生物化学与生物物理学报》的一项研究结果一致,即高脂饮食可提高少突胶质细胞死亡率。但是本研究还发现,与高脂饮食后的正常小鼠相比,CD38基因缺失的小鼠少突胶质细胞数量更多。对此研究人员认为,抑制CD38合成,可提高NAD+水平,从而降低少突胶质细胞死亡率。
由于少突胶质细胞负责产生髓鞘,其数量减少可能意味着髓鞘再生能力降低,从而导致神经系统功能障碍。为此,研究人员给2组正常小鼠分别喂食正常饮食及高脂饮食5周,第5周时将所有小鼠再次随机分组,一组小鼠喂食CD38抑制剂(78c),另一组喂食安慰剂。并且,在第6周诱导小鼠发生脱髓鞘改变,2周后观察小鼠髓鞘恢复情况。
结果发现,不论是正常饮食的小鼠还是高脂饮食的小鼠,与未喂食CD38抑制剂的小鼠相比,喂食CD38抑制剂的小鼠神经元上有更多的髓鞘再生,且髓鞘再生的标志物增加。这说明,抑制CD38合成可提高髓鞘的再生能力。
总之,这项研究表明,高脂饮食可提高突胶质细胞死亡率,从而引发神经系统疾病。但是通过抑制CD38合成来提高NAD+水平,可降低少突胶质细胞死亡率,从而提高髓鞘的再生能力,达到改善神经系统疾病的目的。