1.我们为什么会变老?
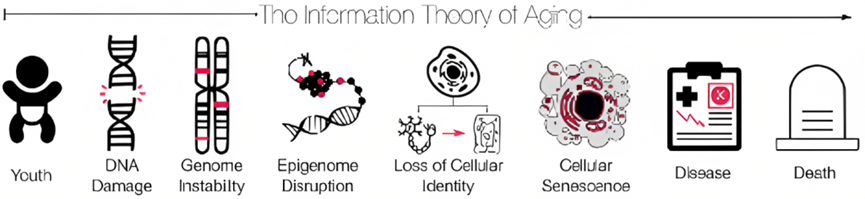
衰老的生物学原因众说纷纭,其中一种理论是哈佛大学教授大卫·辛克莱(David Sinclair)提出的衰老信息理论(Information Theory of Aging)。作为一个有机整体,指导我们身体运行的所需要的信息都蕴含在DNA中,而衰老信息理论指出,随着年龄增长,储存在DNA中信息逐渐无法被正确地表达出来,这个现象被称为表观遗传信息的丢失。其后果便是生物体内各种生化反应的运行过程出现异常和紊乱,也就产生了衰老现象。
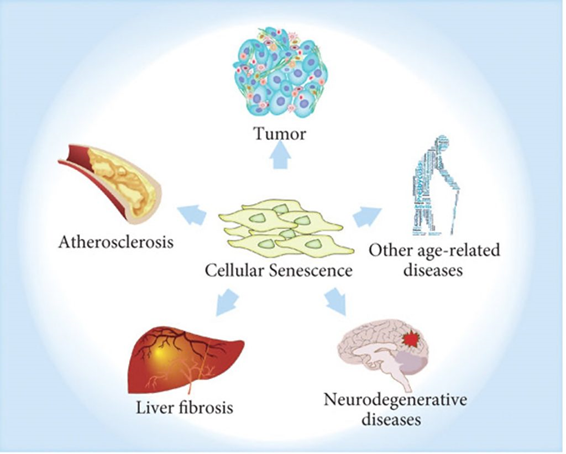
一项由Sinclair和他的同事于2023年完成的研究提供了支持衰老信息理论的证据。该研究发现,衰老是由DNA中的双链断裂引起的,这种特定类型的DNA损伤会导致基因组(所有可能在细胞中被激活的基因)的不稳定,并破坏表观基因组(控制基因组中基因激活的分子)。基因组不稳定和表观基因组破坏会引发细胞身份的丧失,即这些细胞无法正确地激活其基因并做好它的“本职工作”。最终,这种身份的丧失会导致细胞衰老。
2.通过细胞重编程逆转衰老
2012年,日本科学家山中伸弥博士因发现将正常小鼠细胞转化为干细胞的方法而获得诺贝尔生理学或医学奖。他通过强行激活一组四个基因(Oct3/3、Sox2、Klf4和c-Myc)来实现这一目的,于是这些基因被称为“山中因子”。不久之后,这种细胞重编程技术就被应用于衰老逆转实验。
i.细胞重编程如何工作?
生物学时钟
除了实际年龄之外,人们还可以通过测量身体中的各种生物标志物来表征他们的实际健康状况,其中一类标志物便是DNA的甲基化情况。通过添加或去除DNA特定区域上被称为“甲基”的化学标签,我们的身体就能对DNA的表达进行调控,这种调控被称为表观遗传调控。
随着年龄的增长,DNA甲基化的情况会发生变化,与衰老相关的DNA甲基化模式往往会导致细胞运作不良,从而导致疾病等不良结果。这种规律可以被总结成“表观遗传时钟”,用于衡量人们的生物学年龄。当一个人的生理年龄高于他们的实际年龄时,可以认为他们的衰老已经加速了;反之当他们的生理年龄低于他们的实际年龄时,可以认为他们的衰老被逆转了。

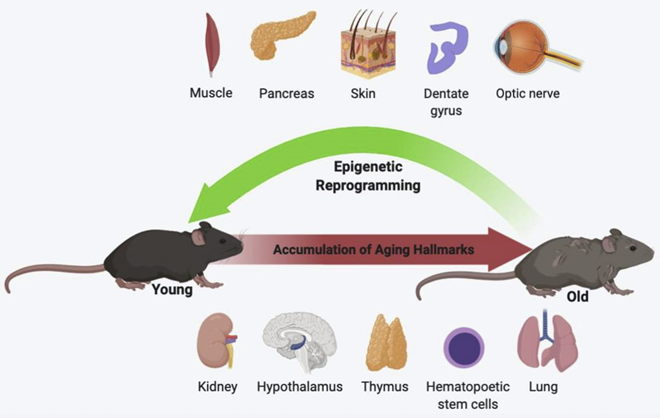
来自Salk Institute和Rejuvenate Bio两家衰老干预公司的研究都表明,细胞重编程可以逆转小鼠的生物学年龄;来自英国巴伯拉罕研究所的科学家也表明,细胞重编程将人类皮肤细胞的表观遗传年龄逆转了三十年,这些研究证明了生物年龄与细胞再生之间的关联。
部分表观遗传重编程
细胞重编程的最终结果是将已经分化成熟的细胞重新转化成没有细胞身份的“婴儿细胞”,即干细胞,这个过程似乎可以消除随着衰老而发生的表观遗传变化。用于重编程的山中因子属于启动基因激活的的转录因子,它们通过启动让细胞成为干细胞(诱导多能干细胞)的基因发挥作用。

然而,将细胞完全重编程回干细胞并不是年龄逆转实验的目标,实际的目标是仅在一定时间内激活山中因子,以在不改变细胞身份的情况下逆转表观遗传衰老。重编程后的神经元依旧是一个神经元,只不过降低了它的表观遗传年龄降。因此,这项技术更精确的说法应该是部分表观遗传重编程,它类似于黑客DNA以将细胞恢复到发育的早期阶段。
通过基因疗法递送山中因子
山中因子如何递送到人体细胞?Rejuvenate Bio用于延长自然衰老小鼠寿命的技术以及Life Biosciences用于恢复灵长类动物视力的技术都使用了腺相关病毒(AAV)介导递送,这些病毒能通过感染细胞的方式有效地将其目标基因(即山中因子)递送到细胞中。与其他病毒介导的递送系统相比,腺相关病毒引起的免疫反应较少。
ii.细胞重编程的效果如何?
重编程延长小鼠寿命
Salk Institute的科学家是第一个证明山中因子能够延长动物寿命的人。在2016年这项开创性的研究中,研究人员表明细胞重编程可以将早衰小鼠的寿命延长20%。早衰小鼠模拟一种称为Hutchinson-Gilford早衰综合症的人类疾病,这种疾病会导致过早衰老。Salk Institute的研究人员将早衰小鼠与经过基因改造的小鼠培育成携带山中因子的小鼠,从而延长了寿命。

2022年,这项研究被法国的科学家进行了重现,重现结果使早衰小鼠的寿命延长了15%。除了逆转骨骼和皮肤衰老的迹象外,法国科学家还发现重编程增加了小鼠的握力,这是肌肉年龄逆转的标志。值得注意的是,法国研究人员使用的小鼠具有较轻的早衰症,并且比索尔克研究所的早衰症小鼠多活了约15周。
继早衰小鼠研究之后,在2023年初,Rejuvenate Bio是第一个通过重新编程来延长自然衰老小鼠寿命的公司。由于所有四种山中因子都被证明会导致正常小鼠的肿瘤生长,因此Rejuvenate Bio研究人员只使用了三种(Oct3/3,Sox2,Klf4[OSK])。值得注意的是,他们用来传递山中因子的基因疗法已经被用于人类身上。
重新编程逆转衰老
在2020年由哈佛大学的David Sinclair博士领导的一项具有里程碑意义的研究中,细胞重编程被用于恢复小鼠的视力。在这项研究中使用了OSK基因治疗方法(类似于Rejuvenate Bio的方法),在2023年又被发现可以恢复非人灵长类动物的视力。基于这些研究的成功,Sinclair表示下一步是恢复人类的视力。

除了逆转视力丧失外,细胞重编程还有可能逆转许多疾病。Salk Institute的科学家已经逆转了自然衰老小鼠肾脏衰老的迹象,这可能导致肾脏疾病的逆转。德国马克斯·普朗克研究所的科学家甚至对心脏细胞进行了重新编程,以防止心脏病发作造成的损害。这些发现对心脏病的逆转具有重要意义。
3.细胞重编程何时能到达消费者手中?
上述研究吸引了众多投资者,目前已有几家生物技术公司正在研究细胞重编程技术,包括谷歌的Calico和Altos Labs。据报道,这些公司得到了亚马逊首席执行官杰夫·贝佐斯(Jeff Bezos)的支持。最近,ChatGPT的创始人山姆·阿尔特曼 (Sam Altman)向Retro Biosciences 投资了1.8亿美元,该公司致力于将细胞重编程作为其重点领域之一来延长人类寿命。
“鉴于目前复兴生物技术的发展轨迹、该领域新发现的速度以及进入该领域的资本量,复兴科学和生物技术很可能在未来几年爆炸式增长。”——Dr. João Pedro de Magalhães and Dr. Alejandro Ocampo, 表观遗传衰老领域的顶尖专家。
话虽如此,在人类测试细胞重编程之前还有很多工作要做。一个主要障碍是通过仅靶向体内特定的细胞群来防止癌症的诱发。此外,培养皿(体外)研究表明,重编程仅对某些细胞有效,因此必须优化细胞重编程的有效性。
过去,人类细胞重编程似乎是遥远未来的一种疗法。直到2006年,山中伸弥和其学生高桥和利证明了四种转录因子可以逆转细胞的表观遗传轨迹。按照这个速度,我们可能会在未来十年内看到细胞重编程在人类身上进行测试。